- ホーム
- 科学映画の活用法
- 培養細胞の顕微鏡撮影「骨形成」の撮影記録から

培養細胞の顕微鏡撮影「骨形成」の撮影記録から
< 金子文雄 >
科学映像館で配信されている映画を見て、撮影材料や撮影方法について知りたいとおっしゃる方もいるのではないかということで、1989年に作られた映画「骨形成」の撮影を担当したスタッフが、当時の撮影ノートを基に製作現場を振り返ってみました。
1989年4月初め
「ビタミンDが軟骨の石灰化・骨化にどのように作用しているか?」をテーマにした映画を製作することになり、監修・指導の先生方にお話を伺って撮影項目を考える。映像化したい項目として、軟骨の成長、軟骨の石灰化、軟骨マトリックスの分泌、骨芽細胞、骨細胞、破骨細胞の振る舞いなどが挙がった。撮影場所が監修・指導の先生の研究室と決まり、近くのアパートに寝泊りする部屋を確保して撮影機材とスタッフ5名で現地入りする。
4月14日
挙げられた項目の映像化が可能かどうか、撮影材料の作り方を検討し、起こる現象を確認しつつ作業したい。マウス胎児の四肢の骨を取り出して観察する。指の骨では中心部に石灰化が始まっている。軟骨の部分と石灰化している部分の境界でちぎれやすく、また、骨の周囲の組織を取り除くことが難しい。この段階では骨襟の膜性骨化ではないのか? 軟骨の石灰化を観るのは骨髄ができた後のほうがいい。新生児の骨を使うほうがいいかもしれないと考える。
4月24日
軟骨細胞のアガロースゲル内培養について考える。立体的な環境では軟骨細胞を球形のまま培養でき、軟骨マトリックスの形成も速いらしい。単個の細胞周辺にもマトリックスが形成され、1週間でインビボの形態に近くなるということだ。アガロースゲル内に細胞を培養すると細胞が三次元的に分布するので、焦点深度の浅い顕微鏡レンズでは一部の細胞にしかピントが合わない。それで、初めに細胞を含まないゲルの層を作り、その上に細胞をサスペンドしたゲルを載せることにした。細胞が下の層のベッドの上に乗るように平面的に分布して、多くの細胞にピントが合うはずだ。
4月28日
マウスの大腿骨を取り出し、関節に近い部分をナイフで削って中をのぞく。強くピペッティングすると骨髄がかなり取り除ける。顕微鏡で観察すると、海綿骨に骨小腔が見える。暗視野照明では教科書に載っているような骨細胞の感じが分かる。材料が厚いためか解像力はあまり良くない。ノマルスキーでの観察がいいかもしれない。
4月30日
マウス胎児の軟骨を厚さ3mmのチャンバーに入れ、倒立顕微鏡にセットして位相差検鏡で撮影を始める。顕微鏡ステージを含む対物レンズからコンデンサまでのエリアはプラスチックの箱で囲って、内部の温度を37度前後に保つとともに、ステージ上の撮影材料を覆う容器には5%の炭酸ガスを含む混合空気を送り込んで、培養器の環境に近づける。倍率の低い撮影で動きを見せるためには撮影のインターバル時間を長くしなければならない。5分に1駒の撮影とする。低い倍率とはいえピントがボケる可能性がないわけではない。温度や炭酸ガス濃度やランプ切れの監視をしつつ交代で休む。48時間後に撮影終了。後日、現像したラッシュフィルムを見るが、骨の成長は確認できなかった。それどころか、フィルムに露出ムラがある。原因を探ったところ、撮影場所が大きな病院で、院内の大型機器の動作で交流100Vの電圧が時に下がることがあった。顕微鏡のランプを直流点灯式に改造することにする。
5月16日
マウス胎児の軟骨を撮影する。照明を暗視野に変え、インターバルは15分に1駒とする。140時間撮影。一回り大きくなったが、成長のイメージがない。軟骨の成長を記録するのは無理なのか?
5月26日
ニワトリの胚から取り出した長さ3mmの大腿骨が4日間で1.5mm長くなった。マウスの大腿骨より断然成長が速い。軟骨成長の撮影はニワトリの骨を使うことに決める。
6月23日
ノマルスキー観察で見る骨細胞は、マウス新生児2~5日のカルバリアがよく見える。胎児カルバリアの骨細胞は、骨細管がまだ充分に発達していない。生後6日目以降は厚くなってシャープさに欠ける。
6月24日
3日前に培養したアガロースゲル内の軟骨細胞の周囲に、軟骨マトリックスが見える。BGJb培地に、FCSを10%加えている。この条件で撮影ができそうだ。細胞の動きとカットの長さを考慮して、撮影のインターバル時間を決めなければならない。
6月26日
鶏胚8日目の大腿骨で、軟骨成長の撮影を始める。顕微鏡レンズでは倍率が大きすぎて、長さ3mmの骨全体が視野に入らない。暗視野照明にするためには、顕微鏡の鏡基、照明装置はそのまま利用したい。使う顕微鏡を倒立顕微鏡から正立顕微鏡に替えて、レボルバーにマイクロニッコールレンズを取り付け、三眼鏡筒は外してレンズの像を直接フィルム面に結像させることにする。マクロレンズは絞りが使えるので、厚みがあるものには有利だ。これで4mm×6.5mmぐらいの範囲の撮影が可能になる。
7月25日
軟骨成長の撮影がずっと続いている。2日で1カットのペースでこれまでに軟骨の成長を17カット撮影したが、途中で形がゆがんだり、画面の下方向に伸びてしまったりで、本番で使えるものが少ない。本番で使えるカットが3つか4つは欲しい。
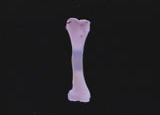
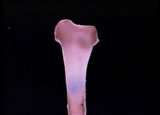
7月27日
プロローグの骨の縦断面移動カットを撮影するために試料を作る。マウス大腿骨を取り出して充分に乾燥させた後、サンドペーパーで長軸に平行に両側から慎重に削っていく。厚み1mmぐらいまで削ると、関節に近い部分の内側に海綿骨が見えるようなるので、水を張ったシャーレの中に入れ、骨髄組織が水を含んでふやけたところで、ピペッティングして骨髄を取り除く。新しく水を張ったシャーレに試料を移して撮影する。ゆっくりした長い距離のステージの移動は人力では上手くいかないので、産業用の直線スライドテーブルを微速度撮影に同期して動作するように改造して使う。

8月1日
鶏胚13日目の胸骨の軟骨細胞を、1%アガロースゲル内に封入して撮影を始める。未熟な段階からの撮影なので、画面のどの位置に軟骨マトリックスが作られるのか予想がつかない。良いカットになるかどうかは細胞の振る舞い次第だ。
8月15日
軟骨石灰化の撮影を始める。蝶番の両側にカミソリの刃を取り付け、刃と刃の間が0.5mmぐらいになるように固定すると、刃先の間が平行になって、試料がきれいに切り出せるナイフが作れる。7日目のマウス大腿骨を取り出し、このナイフで縦断切片を作って培養する。位相差検鏡は細胞にコントラストが付いてよく見えるが、石灰化した黒い部分との差が分かりにくいので、暗視野照明で撮影することにした。生体で成長していた勢いのある間を狙っての撮影なので長時間追うことは無理かもしれない。インターバルは短めにしてカットの長さを稼ぐ。
9月20日
昨日からまた、未熟な段階の軟骨細胞を撮り始めたが、ゲルが動いたり、画面の中の細胞が何個か死んだりして、NG続きだ。夜になって3度目の撮影を始める。
9月25日
20日から撮影していた軟骨細胞の周囲に、大きな軟骨マトリックスが作られた。3分に1駒の撮影で長期戦の構えだ。3日目頃から良いカットになりそうな予感で気持が高揚する。長い1カットになったが、細胞の動きは良い感じになっているだろうか? 結果が良かったので高倍率の映像も数カット稼ぐ。現像所から戻ってくるのが楽しみだ。
11月17日
この1カ月、後回しになっていた骨芽細胞や破骨細胞、実験や撮影風景などの情景カットを撮りためて最後の撮影となった。
こうして6カ月を越える撮影は終わりました。撮影現場の雰囲気は感じていただけたでしょうか。効率重視の現在から見れば贅沢な映画作りといわれそうですが、時間とコストを費やして手にできる映像もあるのかなと思います。科学映像館の努力で、外界の音も聞こえず照明も落とした小さな映画館で、ただスクリーンを見つめて鑑賞する、そんな体験をしていただける機会が増えればいいなと期待しております。





